Nos produits en cours de développement
Les informations contenues ici sont en cours d’investigation clinique. A ce jour, les produits issus de la technologie Viaskin™ et la technologie en elle-même n’ont été approuvés par aucune agence réglementaire quel qu’en soit l’usage.
Grâce à notre technologie innovante de patch épicutané (Viaskin™), nous développons un portefeuille de produits pour les personnes souffrant d’allergies alimentaires avec pour objectif de potentiellement révolutionner la prise en charge leur étant destinée.
Nous remercions tous les patients, soignants, médecins et équipes de chercheurs qui participent et ont participé au développement de nos essais cliniques et qui nous aident et ont aidé à progresser dans l’élaboration de Viaskin™.
Produits en cours de développement
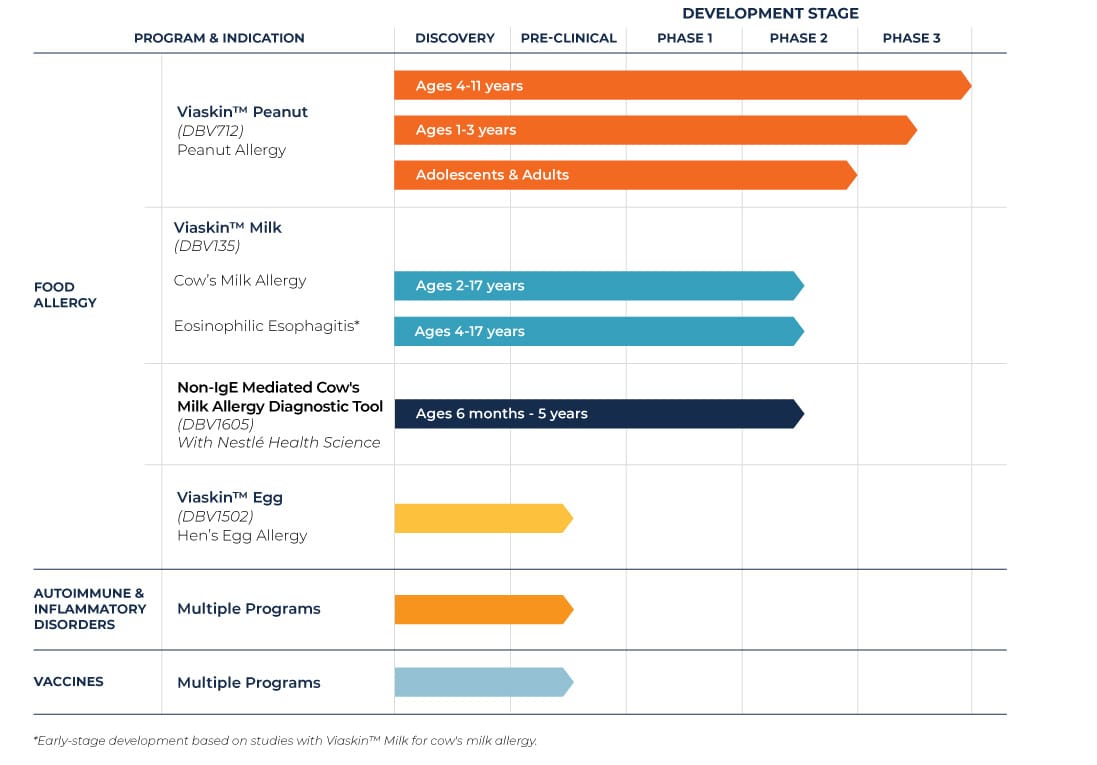
Essais cliniques portant sur les allergies alimentaires
DBV dispose d’un programme de développement important, avec notamment des essais cliniques en cours sur Viaskin Peanut et Viaskin Milk ainsi que des travaux précliniques sur Viaskin Egg.
Les essais cliniques portant sur Viaskin™ Peanut
L’allergie à l’arachide est l’une des allergies alimentaires les plus courantes et peut causer des réactions allergiques graves, potentiellement mortelle, ainsi que l’anaphylaxie.
Nous avons mis en place un programme de recherche clinique complet pour Viaskin Peanut. Viaskin™ Peanut bénéficie d’un programme de recherche clinique exhaustif, avec notamment une étude de Phase III à long terme chez des enfants de 4 à 11 ans en cours, ainsi que deux essais de Phase III chez des patients âgés de 1 à 3 ans.
* Viaskin™ Peanut est un produit expérimental et n’a été autorisé pour aucune indication dans aucun pays.
Les essais cliniques portant sur Viaskin™ Milk
L’allergie aux protéines du lait de vache (APLV) apparait principalement dans la première année de vie et touche environ 2 à 3 % de la population dans les pays développés.
Nous avons réalisé un essai de Phase I/II pour étudier la sécurité d’emploi et l’efficacité de Viaskin™ Milk auprès de populations de patients pédiatriques.
* Viaskin™ Milk est un produit expérimental et n’a été autorisé pour aucune indication dans aucun pays.
Études précliniques portant sur Viaskin™ Egg
L’allergie à l’œuf de poule est l’une des allergies alimentaires les plus courantes chez les enfants. Plusieurs études mondiales indiquent que l’allergie à l’œuf de poule affecterait 1,5 à 3 % des jeunes enfants.
La troisième allergie alimentaire en recherche de traitement avec Viaskin™, est l’allergie à l’œuf de poule. Des recherches précliniques ont été initiées pour Viaskin™ Egg.
* Viaskin™ Egg est un produit expérimental et n’a été autorisé pour aucune indication dans aucun pays.
Les autres programmes au stade précoce de développement
Des approches expérimentales au-delà des allergies alimentaires.
DBV étudie d’autres domaines dans lesquels il existe des besoins médicaux non satisfaits importants, tels que l’œsophagite à éosinophiles (EoE), les maladies inflammatoires et les maladies auto-immunes , ainsi que l’application potentielle de la technologie Viaskin™ aux vaccins.
Diagnostics cliniques
En même temps que DBV cherche à diversifier son portefeuille de recherche, la société explore également l’utilisation de sa plateforme technologique pour le développement d’outils de diagnostic des allergies alimentaires. En 2016, DBV s’est engagé dans une collaboration mondiale exclusive avec Nestlé Health Science pour le développement de MAG1C, un patch-test prêt à l’emploi et standardisé, pour potentiellement diagnostiquer l’allergie aux protéines de lait de vache chez les nourrissons et les enfants en bas âge.
