Programme de développement :
Viaskin™ Peanut
L’allergie aux arachides est l’une des allergies alimentaires les plus fréquentes. Elle peut entraîner de graves réactions allergiques, potentiellement mortelle, ainsi que des anaphylaxies.
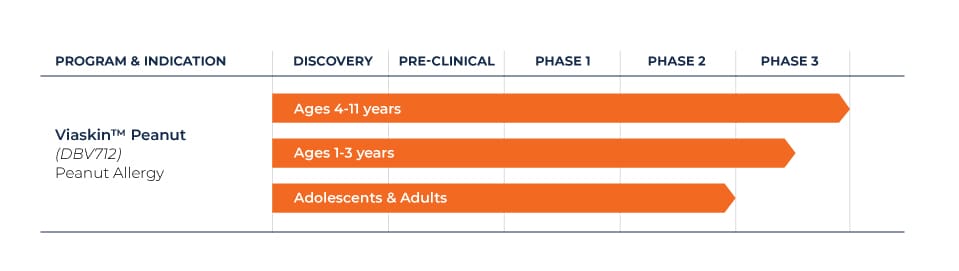
Nous avons mis en place un programme complet de recherches et d’essais cliniques pour Viaskin™ Peanut. Une études de phase 3 à long terme menées chez des enfants âgés de 4 à 11 ans sont en cours, ainsi qu’un essai de phase 3 chez des enfants âgés de 1 à 3 ans.
Essais cliniques en cours
VITESSE
Cet essai clinique évalue un patch expérimental appelé DBV712 pour les enfants de 4 à 7 ans souffrant d’une allergie à l’arachide. L’objectif principal de cette étude est de déterminer l’efficacité et la sécurité du patch à l’étude (DBV712) par rapport à un patch placebo chez les enfants souffrant d’allergie à l’arachide. La petite quantité de protéines d’arachide contenue dans le patch est conçue pour potentiellement désensibiliser (ou rendre moins sensible) une personne allergique à l’arachide par des expositions répétées à de très petites quantités d’arachides par la peau.
En savoir plus
Essais cliniques réalisés
EPITOPE (EPIT™ chez les tout-petits ayant une allergie aux arachides)
EPITOPE est un essai clinique mondial de Phase 3 qui évalue la sécurité et l’efficacité de Viaskin™ Peanut pour le traitement des patients allergiques aux arachides âgés de 1 à 3 ans. EPITOPE est un essai pivot en double aveugle contrôlé par placebo et conduit en deux parties consécutives.
En savoir plus
REALISE (Real Life Use and Safety of EPIT™ [Utilisation concrète et sécurité d’EPIT™])
REALISE est un essai clinique de phase 3 multicentrique, randomisé, en double aveugle et contrôlé par placebo. L’essai vise à évaluer l’utilisation de Viaskin™ Peanut 250 µg dans le cadre de la pratique courante de l’exercice médicale ainsi que de générer des données de sécurité au travers d’une période de six mois de traitement en aveugle, suivis de 36 mois de traitement en ouvert. L’étude a inclus 393 patients de 4 à 11 ans.
PEOPLE (PEPITES Open Label Extension Study [Études d’extension en ouvert PEOPLE])
PEOPLE est un essai clinique d’extension de phase 3 de Viaskin™ Peanut. Cet essai a inclus plus de 300 patients. Les patients éligibles au recrutement dans l’essai PEOPLE étaient ceux ayant participé à l’intégralité des 12 mois de traitement de PEPITES, un essai de Phase 3 en double aveugle et contrôlé par placebo. Les patients recrutés ont pu recevoir jusqu’à 60 mois de traitement en ouvert par Viaskin™ Peanut 250 µg.
En savoir plus
PEPITES (Peanut EPIT™ Efficacy and Safety Study [Étude sur l’efficacité et la sécurité de Peanut EPIT™ ])
PEPITES est un essai clinique mondial pivot de phase 3, mené en double aveugle et contrôlé par placebo, conçu pour évaluer la sécurité et l’efficacité de Viaskin™ Peanut 250 µg chez les enfants âgés de 4 à 11 ans. L’étude a inclus 356 patients.
En savoir plus
OLFUS-VIPES (Étude de suivi en ouvert – Efficacité et sécurité de Viaskin™ Peanut)
OLFUS-VIPES est un essai clinique de Phase 2b de suivi en ouvert. Cet essai a été effectué à la suite de l’essai VIPES. L’étude a évalué l’efficacité et la sécurité à long terme de Viaskin™ Peanut. L’étude a inclus 171 patients qui avaient précédemment reçu soit un placebo, soit une des trois doses de Viaskin™ Peanuts administrées pendant l’essai VIPES.
En savoir plus
VIPES (Viaskin™ Peanut’s Efficacy and Safety[Efficacité et sécurité de Viaskin™ Peanut])
VIPES est un essai clinique en double aveugle, contrôlé par placebo et multicentrique, destiné à étudier la sécurité et l’efficacité de trois doses de Viaskin™ Peanut (50 µg, 100 µg, 250 µg). L’étude a inclus 221 patients âgés de 6 à 55 ans.
En savoir plus
Essai clinique de phase Ib
La sécurité et la tolérabilité de Viaskin™ Peanut a été évaluée pendant un essai de Phase 1b. L’étude a inclus 100 patients âgés de 6 à 50 ans.
En savoir plus
Collaborations externes : essais portant sur Viaskin Peanut
CoFAR6 (Consortium for Food Allergy Research 6 [Consortium pour la recherche sur l’allergie alimentaire 6])
En octobre 2013, le Consortium pour la recherche sur l’allergie alimentaire, ou CoFAR, a initié un essai clinique multicentrique, randomisé en double aveugle, et contrôlé par placebo afin d’évaluer Viaskin™ Peanut chez les enfants et les adultes âgés de 4 à 25 ans. L’étude initiale de 52 semaines a inclus 75 patients. Par la suite 59 patients ont participé à l’extension à long terme de l’essai ; ils se sont vu recevoir un traitement actif pour une période totale de de 30 mois (130 semaines). Cet essai a été parrainé et financé par l’Institut national des allergies et des maladies infectieuses (NIAID) un institut du National Institutes of Health (NIH) des États-Unis.
En savoir plus
ARACHILD
ARACHILD est un essai clinique multicentrique, en double aveugle, contrôlé par placebo de 18 mois conçu pour évaluer l’efficacité et la sécurité de Viaskin™ Peanut chez 54 enfants âgés de 5 à 17 ans. L’étude a été parrainée par l’Assistance Publique-Hôpitaux de Paris (AP-HP).
En savoir plus
* Viaskin™ Peanut est un produit expérimental dont l’utilisation n’a été approuvée dans aucun pays quel qu’en soit l’usage.
